Uno de los primeros científicos de la historia de la química fue Robert Boyle (1627-1691). Este científico británico es conocido actualmente por su ley acerca del comportamiento de los gases, la Ley de Boyle¹. Sin embargo, ¿conocemos qué le llevo hasta ella?, ¿cuál era la situación de la ciencia en ese momento?, ¿cuáles fueron los experimentos que llevaron a Boyle a esa conclusión?
En este artículo trataremos de poner en contexto el trabajo de este científico, explicaremos en qué consiste la Ley de los gases de Boyle y propondremos un pequeño experimento casero que facilitará su comprensión.
Boyle nació en una época en la que aún reinaba la alquimia. Se tenía una fe ciega en la transmutación de los elementos, entre otras cosas para crear oro, y en la existencia de una fuente de vida eterna. Se consideraba que habían cuatro principios o elementos básicos: la Tierra, el Aire, el Fuego y el Agua. Boyle pretendía reemplazar estas ideas místicas por una que fuera racional y empírica.

Figura: Representación de los cuatro elementos considerados por los alquimistas: Tierra, Fuego, Aire y Agua.
Boyle era un hombre de inmensa curiosidad, lo cual le llevó a estudiar gran cantidad de fenómenos. Examinó los cristales y sus estructuras, investigó el color e ideó el primer indicador ácido-base basado en un concentrado de violetas. Preparó hidrógeno (sin darse cuenta) al meter clavos de hierro en ácido sulfúrico². Escribió el primer libro en inglés sobre la electricidad. Estudió los diferentes estados de la materia y descubrió que casi todos los líquidos se contraían al congelarse, mientras que el agua se dilataba. Demostró que aparecía un gas (luego se vio que era dióxido de carbono) si vertía vinagre sobre coral en polvo (que contiene mayoritariamente carbonato cálcico). Investigó las propiedades de la sangre y se interesó por la posibilidad de hacer transfusiones.

Figura: Retrato de Robert Boyle.
Estas investigaciones y muchas otras quedaron relatadas por Boyle en un lenguaje sencillo y claro, un lenguaje cercano al que hoy en día podemos observar en cualquier artículo científico, dejando atrás así el ocultismo de la alquimia.
En su libro Nuevos experimentos, Boyle explicaba con todo lujo de detalles más de cuarenta experimentos que había realizado utilizando una bomba de vacío que le había fabricado su ayudante Robert Hooke³. De esta forma comienza a despertar su interés acerca del comportamiento de los gases y en 1662 descubre que el aire podía ser comprimido.
Boyle consiguió este efecto introduciendo aire en el final de un tubo de vidrio cerrado en forma de J, de algo más de 5m de longitud. Vertió en él mercurio a fin de cerrar el fondo curvo. Observó que si añadía más mercurio por el extremo abierto, el peso de ese mercurio adicional comprimía más y más el aire atrapado en el extremo cerrado, con lo que su volumen decrecía. Así pues, Boyle halló que el volumen de un gas variaba en proporción inversa a la presión a que se le sometía. O sea que si se doblaba el peso del mercurio sobre el aire, este reducía su volumen a la mitad del original; si se triplicaba aquel peso, este volumen disminuía a un tercio, y así sucesivamente. Siendo esto es lo que se llama Ley de Boyle.
En otras palabras Robert Boyle encontró la siguiente relación entre el volumen de un gas y la presión:

 Figura: Representación de la Ley de Boyle mediante un juego de pistones en los que se varía el volumen del gas y en donde se puede observar cómo se ve afectada la presión del mismo.
Figura: Representación de la Ley de Boyle mediante un juego de pistones en los que se varía el volumen del gas y en donde se puede observar cómo se ve afectada la presión del mismo.
Esta ley puede expresarse por medio de la siguiente proporción:
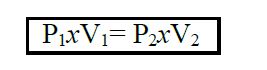
La conclusión más importante de este experimento era que el aire tenía naturaleza atómica, y que sus átomos estaban muy separados entre sí. Con la presión, los átomos eran forzados a aproximarse, con lo que el volumen disminuía. Boyle demolió completamente la antigua creencia de que el aire era un medio etéreo que lo impregnaba todo, demostrando que era una sustancia material con propiedades físicas y químicas propias, y que podía comprimirse o incluso pesarse 4.
No obstante, a pesar de esta demostración fue necesario que transcurriese siglo y medio para que el atomismo se impusiera por completo dentro la comunidad científica.
Experimento:
Vamos a demostrar de la Ley de Boyle mediante un sencillo experimento casero, observando como la disminución del volumen va a dar lugar a un aumento de presión.
Material:
- Una botella de plástico
- Un bol con agua
- Un globo
Procedimiento:
Cortamos una botella de plástico a la mitad y adherimos el globo en la parte superior, tal y como se ve en la imagen (si es necesario añadimos un poco de cinta aislante).
Introducimos nuestra botella con el globo en el recipiente con agua, y observamos lo que ocurre cuando variamos el volumen del aire que queda entre la superficie del agua y la boca de la botella:
- Cuando el volumen es mayor, el globo se mantiene desinflando, lo cual indica que la presión es menor.
- Cuando el volumen disminuye, el globo se infla, con lo cual podemos afirmar que la presión es mayor.
Y con este sencillo experimento hemos podido demostrar la Ley de Boyle para los gases a temperatura constante.

Constanza Ruiz Domínguez
1.También se conoce como la Ley de Boyle- Mariotte.Edme Mariotte (1620-1684) estudió también la comprensión de los gases. Ambos científicos Boyle y Mariotte, de forma independiente llegaron a la misma ley. Como curiosidad, Boyle en sus trabajos no especificó que la temperatura debía ser constante para que la ley fuese válida mientras que Mariotte sí hizo.
2.![]()
3.El propio Hooke (1635-1703) se convertiría en un prodigio de la ingeniería. Fue uno de los científicos más relevantes a lo largo de la historia de la ciencia experimental y hoy por hoy lo podemos recordar por su ley acerca de la elasticidad
4. En el caso de los líquidos y los sólidos se observaba que no podían comprimirse con la misma facilidad que los gases, lo cual no significaba necesariamente que no estuvieran compuestos de átomos. En estos casos, los átomos debían de estar en contacto
Bibliografía:
- Asimov, Isaac (2014). Historia y cronología de la ciencia y los descubrimientos. Editorial Planeta: Barcelona.
- Asimov, Isaac (2006). Breve Historia de la Química. Ed. Alianza: Madrid.
- Babor, José A. (1935). Química General. Manuel Martín Editor: Barcelona.
- Sacks, Oliver (2007). El tío Tungsteno. Anagrama. Colección Compactos: Barcelona.
- Fotografías de: Oscar Keys, Jamie Street, Jeff King y Kaushik Panchal. Banco de imágenes: https://unsplash.com/



Pingback: El Hidrógeno como fuente de energía – Yo Soy Tu Profe
Pingback: EL FIN DE LA ALQUIMIA Y EL NACIMIENTO DE LA QUÍMICA – Historia F+Q