En la clase de hoy veremos los óxidos y anhídridos en las primeras entradas sobre formulación inorgánica.
¿Qué son los óxidos metálicos ?
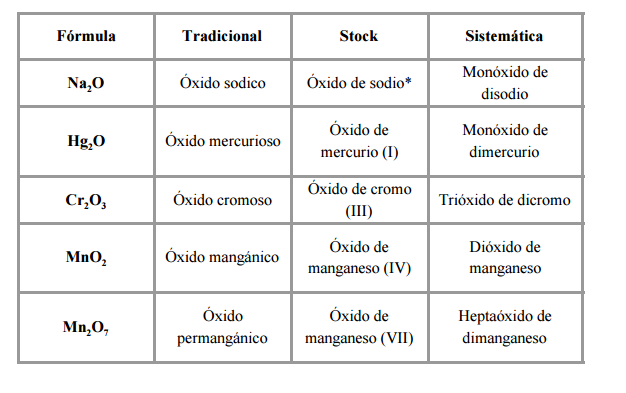
Los óxidos metálicos están formados por un elemento metálico más oxígeno. Se trata de compuestos binarios cuya fórmula X2On (donde X es el elemento metálico y O es oxígeno). En estos compuestos el oxígeno presenta un estado de oxidación -2, definirían la parte electronegativa del compuesto y se denominaría “óxido”. La lectura de los compuestos se realiza nombrando el óxido seguido del elemento que le precede.
La nomenclatura tradicional: se nombra con la palabra óxido seguida del elemento metálico (teniendo en cuenta la valencia del elemento metálico).

* Cuando el elemento sólo tiene una valencia no es necesario indicar el estado de oxidación. Los prefijos en el elemento metálico se añaden cuando puede llevar a confusión el no incluirlos.
La nomenclatura de stock: indicando el estado de oxidación del elemento metálico en número romanos (entre paréntesis) y siempre determinado por la expresión «óxido de» + elemento metálico.
Nomenclatura sistemática: se indica mediante un prefijo el número de átomos de cada elemento.
Los prefijos utilizados que indican el número de átomos en esta nomenclatura son:
- 1 átomo: Mono
- 2 átomos: Di
- 3 átomos: Tri
- 4 átomos: Tetra
- 5 átomos: Penta
- 6 átomos: Hexa
- 7 átomos: Hepta
- …
* Cuando el elemento sólo tiene una valencia no es necesario indicar el estado de oxidación. Los prefijos en el elemento metálico se añaden cuando puede llevar a confusión el no incluirlos.
Te puede interesar..
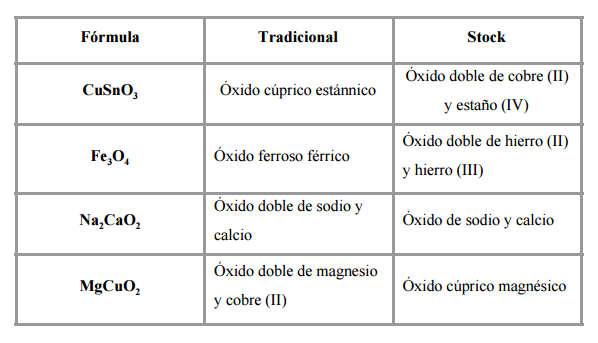
Óxidos dobles
Se trata de compuestos en los cuales la parte electropositiva está constituida por dos elementos diferentes o por un elemento con dos estados de oxidación. En este caso el oxígeno continúa actuando con un estado de oxidación -2.
Los Anhídridos …
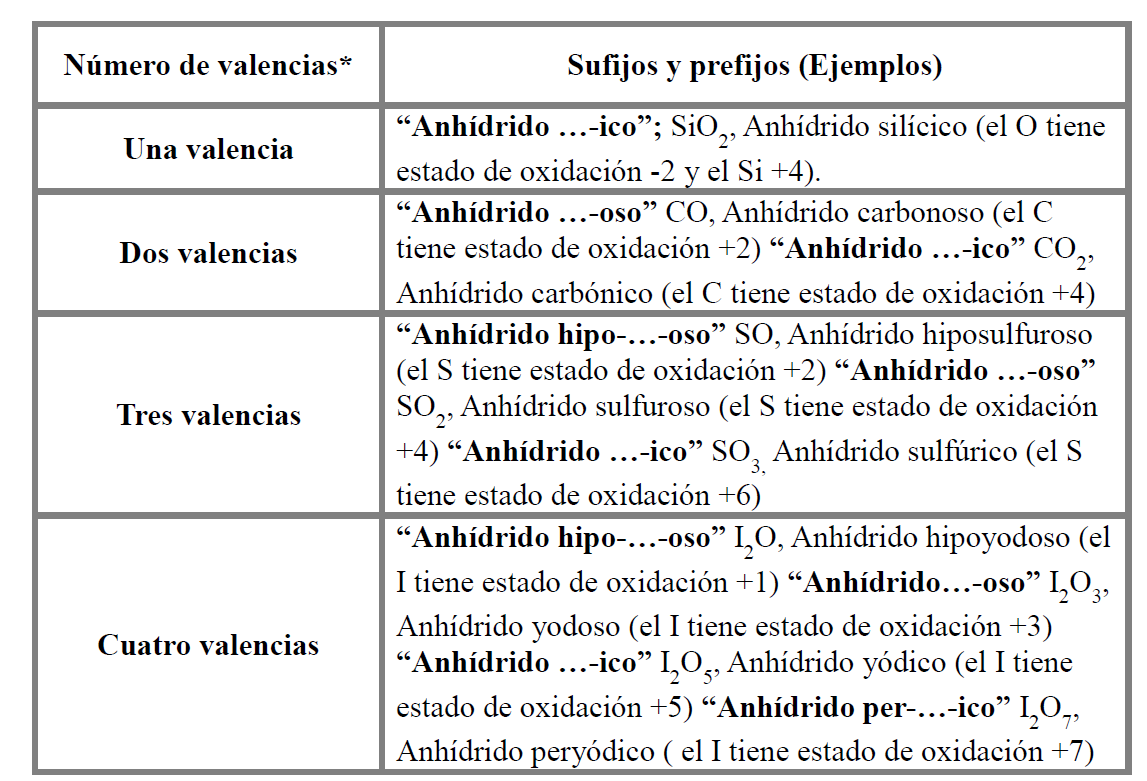
Los anhídridos son compuestos formados por un elemento no metálico más oxígeno. La fórmula de los anhídridos es del tipo X2On (donde X es un elemento no metálico y O es oxígeno). En estos compuestos el oxígeno también presenta un estado de oxidación -2.
Nomenclatura tradicional: se nombra con la palabra anhídrido seguida del elemento metálico (teniendo en cuenta la valencia del elemento metálico).
Nomenclatura de stock: indicando el estado de oxidación del elemento metálico en número romanos (entre paréntesis) y siempre determinado por la expresión «óxido de» + elemento metálico.
Para la nomenclatura sistemática: se indica mediante un prefijo el número de átomos de cada elemento.
Pon en práctica lo aprendido sobre óxidos y anhídridos pinchando en la siguiente imagen:

Si tienes cualquier duda sobre óxidos y anhídridos puedes dejar un comentario aquí. De esta manera, otras personas podrán ver la consulta y la solución correspondiente y así contribuimos a compartir juntos.
¡No lo olvides! Síguenos en las redes 🙂
Facebook,Twitter,Instagram o YouTube
Nos vemos en la siguiente clase.
Agradecimientos a Constanza Ruiz, doctora en Química, quién ha realizado dicha presentación.
Quizás te interese…












Como mola tu rincón. Lo utilizas también para dar clases ¿?
Muchas gracias! Sí, en eso estamos 🙂
Ojalá hubiera tenido yo profesores así.. todo el ánimo. Si lo recuerdo reblogeo alguna =O)
Lo mío siempre fueron las letras y lo creatívo pero admíro a las personas q disfrutan con la lógica matemática 🙂
Intentamos que la educación sea transversal (recomendando algunas lecturas entre otras cosas). Esperamos así que las ciencias te resulten, al menos, entretenidas 🙂
Gracias 🙂
Aun que ahora escribo poesía soy de ciencias. Gracias por refrescarme la memoria. Un cordial saludo.
Qué sería de este mundo sin la poesía! Gracias a ti 🙂
Pingback: Formulación inorgánica: hidruros – Yo Soy Tu Profe
Buenas noches. Mi nombre es José Antonio Barrera y vivo en Málaga, capital. Me he aficionado a la química con el fin de ayudar a mi nieto. Aunque lo cierto es que me ha enganchado y me entretiene mucho.
Querría solventar una duda respecto a los anhídridos.
Como sabe, las reglas de IUPAC 2005 recomienda la eliminación de la nomenclatura tradicional en los compuestos binarios, léase anhídridos, por ejemplo. Dichas reglas están en vigor para eso, bachiller y universidad.
No obstante, en su web, aun estando fechada en 2016, siguen apareciendo los citados anhídridos. ¿Sería tan amable de comentarme algo al respecto?. Le quedo muy agradecido de antemano.
José Antonio Barrera Núñez, Málaga
Estimado José Antonio. Felicito su afición por la química pues comparto ese entusiasmo.
Le comento que estoy con usted en esas actualizaciones de la IUPAC, pero como científica he de decir que a pesar de lo que esta recomendado, en los libros (puede que no de texto, pero si de consulta para universitarios) sigue apareciendo esta nomenclatura tradicional. Por esta razón, y sin querer contradecir a la IUPAC se ha determinado continuar estableciendo las pautas necesarias para entender esta terminología.
Igualmente agradezco su comentario y espero que nos siga consultando.
Dra. Constanza Ruiz Domínguez
Dra. Constanza, muchísimas gracias por sus comentarios a mi consulta.
Seguiré teniendo en cuenta los anhídridos como hasta ahora.
Como decía aquél: «mas vale que sobre, que no que falte” o «better one more than one short»
Reciba un cordial saludo.
José Antonio Barrera Núñez
me podrían aclarar una duda por favor
se puede formar anhídridos con el flúor y el ciano
Bueno ami y a mis hijas no alludo mucho
Gracias !
Qué tal, tengo una duda.
Revisé algunas bibliografías y para los anhídridos en la nomenclatura tradicional algunos me marcan como óxidos de (elemento no metálico), ya no se le pone el nombre de «anhídrido». ¿Llega a un punto el número de compuestos formados que hace que deje de llamarse anhídrido?